የጥሩ ጋዝ ባህሪያትን ማጥናት በፊዚክስ ውስጥ ጠቃሚ ርዕስ ነው። የጋዝ ስርዓቶች ባህሪያት መግቢያ የቦይል-ማሪዮት እኩልታ ግምት ውስጥ በማስገባት ይጀምራል, ምክንያቱም የመጀመሪያው በሙከራ የተገኘ የሃሳባዊ ጋዝ ህግ ነው. በጽሁፉ ውስጥ በዝርዝር እንመልከተው።
ሀሳባዊ ጋዝ ማለት ምን ማለት ነው?
ስለ ቦይል-ማሪዮት ህግ እና ስለ ሚገልጸው ቀመር ከማውራታችን በፊት ሃሳባዊ ጋዝን እንገልፃለን። በተለምዶ እንደ ፈሳሽ ነገር የሚታወቅ ሲሆን በውስጡም የተፈጠሩት ቅንጣቶች እርስበርስ የማይገናኙበት እና መጠኖቻቸው በቸልተኝነት ከአማካይ የመሃል ክፍል ርቀቶች ጋር ሲነፃፀሩ።
በእውነቱ ማንኛውም ጋዝ እውነተኛ ነው ማለትም በውስጡ ያሉት አተሞች እና ሞለኪውሎች የተወሰነ መጠን ስላላቸው በቫን ደር ዋልስ ሃይሎች አማካኝነት እርስበርስ አይገናኙም። ነገር ግን በከፍተኛ ፍፁም ሙቀቶች (ከ 300 ኪ.ሜ በላይ) እና ዝቅተኛ ግፊቶች (ከአንድ ከባቢ አየር ያነሰ) የአተሞች እና ሞለኪውሎች የኪነቲክ ሃይል ከቫን ደር ዋልስ መስተጋብር ሃይል በጣም የላቀ ነው ስለዚህ በተጠቀሰው ትክክለኛ ጋዝ ላይከፍተኛ ትክክለኛነት ያላቸው ሁኔታዎች እንደ ጥሩ ሊቆጠሩ ይችላሉ።
Boyle-Mariotte Equation
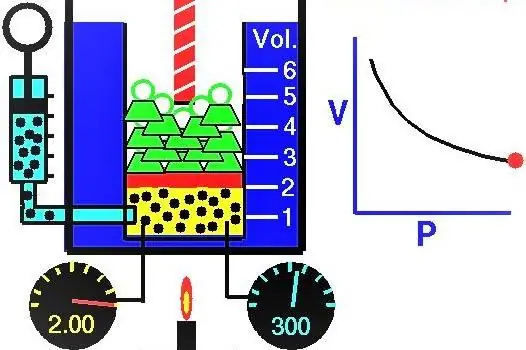
የጋዞች ባህሪያት አውሮፓውያን ሳይንቲስቶች በXVII-XIX ክፍለ-ዘመን በንቃት ቃኝተዋል። በሙከራ የተገኘ የመጀመሪያው የጋዝ ህግ የጋዝ ስርዓትን የማስፋፋት እና የመጨመቅ ሂደትን የሚገልጽ ህግ ነው። ተጓዳኝ ሙከራዎች በ 1662 በሮበርት ቦይል እና በኤድ ማሪዮቴ በ 1676 ተካሂደዋል. እነዚህ ሳይንቲስቶች እያንዳንዳቸው በተናጥል በተዘጋ የጋዝ ስርዓት ውስጥ ባለው የ isothermal ሂደት ውስጥ ግፊቱ ከድምጽ ጋር በተቃራኒው እንደሚለዋወጥ አሳይቷል። በሙከራ የተገኘው የሂደቱ ሒሳባዊ መግለጫ በሚከተለው ቅጽ ተጽፏል፡-
PV=k
P እና V በሲስተሙ ውስጥ ያለው ግፊት እና መጠኑ ሲሆኑ k የተወሰነ ቋሚ ነው, ዋጋው በጋዝ ንጥረ ነገር እና በሙቀት መጠን ይወሰናል. በግራፍ ላይ የ P (V) ተግባርን ጥገኝነት ከገነቡ ሃይፐርቦላ ይሆናል። የእነዚህ ኩርባዎች ምሳሌ ከዚህ በታች ይታያል።
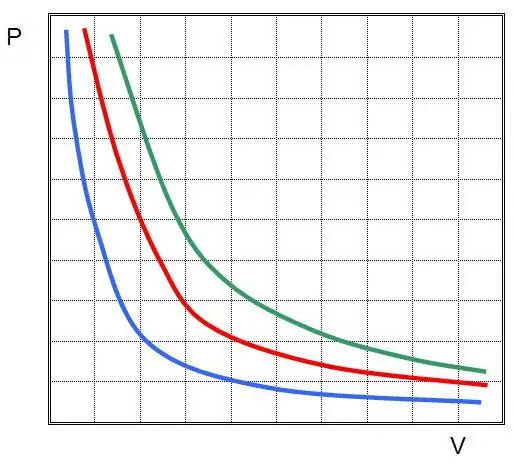
የተጻፈው እኩልነት የቦይል-ማሪዮት እኩልነት (ህግ) ይባላል። ይህ ህግ በአጭሩ እንደሚከተለው ሊቀረጽ ይችላል-በቋሚ የሙቀት መጠን ውስጥ ተስማሚ ጋዝ መስፋፋት በውስጡ ያለውን ግፊት ወደ ተመጣጣኝ መቀነስ ያስከትላል ፣ በተቃራኒው የጋዝ ስርዓት isothermal መጨናነቅ በውስጡ ካለው ተመጣጣኝ ግፊት ጋር አብሮ ይመጣል።
ጥሩው የጋዝ እኩልታ
Boyle-Mariotte ህግ የሜንዴሌቭን ስም የያዘ እና የአጠቃላይ ህግ ልዩ ጉዳይ ነው።ክላፔይሮን ኤሚል ክላፔይሮን በተለያዩ ውጫዊ ሁኔታዎች ውስጥ ስለ ጋዞች ባህሪ የሙከራ መረጃን በማጠቃለል በ 1834 የሚከተለውን እኩልታ አገኘ:
PV=nRT
በሌላ አነጋገር የአንድ ጋዝ ስርዓት V መጠን ያለው ምርት እና በውስጡ ያለው ግፊት P በቀጥታ ከሙቀቱ T እና የቁስ መጠን ጋር በቀጥታ ተመጣጣኝ ነው። የዚህ ተመጣጣኝነት መጠን በ R ፊደል ይገለጻል እና ጋዝ ሁለንተናዊ ቋሚ ይባላል. በ 1874 ዲሚትሪ ኢቫኖቪች ሜንዴሌቭ በዲሚትሪ ኢቫኖቪች ሜንዴሌቭ የተሰራውን በበርካታ ቋሚዎች በመተካት የ R ዋጋ ታየ. በ 1874.
ከአለም አቀፋዊ የግዛት እኩልታ መረዳት ቀላል ነው የሙቀት መጠኑ ቋሚነት እና የቁሱ መጠን የቀኝ ጎኑ ተለዋዋጭነት ዋስትና ይሰጣል ይህም ማለት በግራ በኩል ያለው እኩልነት እንዲሁ ቋሚ ሆኖ ይቆያል.. በዚህ አጋጣሚ የቦይል-ማሪዮት እኩልታ እናገኛለን።

ሌሎች የጋዝ ህጎች
ከላይ ባለው አንቀጽ ላይ የተጻፈው የ Clapeyron-Mendeleev እኩልታ ሶስት ቴርሞዳይናሚክስ መለኪያዎችን ይዟል P፣V እና T እያንዳንዳቸው ከተስተካከሉ እና የተቀሩት ሁለቱ እንዲቀየሩ ከተፈቀደ ቦይል-ማሪዮት እናገኛለን። የቻርለስ እና ጌይ-ሉሳክ እኩልታዎች። የቻርለስ ህግ ለአይሶባሪክ ሂደት በድምጽ እና በሙቀት መካከል ስላለው ቀጥተኛ ተመጣጣኝነት ይናገራል ፣ እና የጌይ-ሉሳክ ህግ በኢሶኮሪክ ሽግግር ሁኔታ የጋዝ ግፊቱ ከፍፁም የሙቀት መጠን ጋር ሲነፃፀር ይጨምራል ወይም ይቀንሳል። ተጓዳኝ እኩልታዎች ይህንን ይመስላሉ፡
V/T=const ጊዜ P=const፤
P/T=const ጊዜ V=const።
ስለዚህስለዚህ የቦይል-ማሪዮት ህግ ከሶስቱ ዋና የጋዝ ህጎች አንዱ ነው። ነገር ግን፣ ከግራፊክ ጥገኝነት አንፃር ከሌሎቹ ይለያል፡ ተግባራቶቹ V(T) እና P(T) ቀጥ ያሉ መስመሮች ናቸው፣ ተግባሩ P(V) ሃይፐርቦላ ነው።
የቦይል-ማሪዮት ህግን ተግባራዊ ለማድረግ የተግባር ምሳሌ
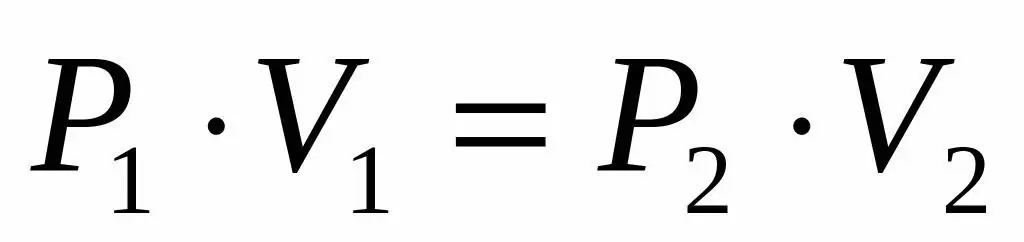
በመጀመሪያው ቦታ በፒስተን ስር ባለው ሲሊንደር ውስጥ ያለው የጋዝ መጠን 2 ሊትር ሲሆን ግፊቱ 1 ከባቢ አየር ነበር። ፒስተን ከተነሳ በኋላ የጋዙ ግፊት እና የጋዝ ስርዓቱ በ 0.5 ሊትር ጨምሯል. ሂደቱ እንደ isothermal ይቆጠራል።
የተመሳሳይ ጋዝ ግፊት እና መጠን ስለተሰጠን እና በሚስፋፋበት ጊዜ የሙቀት መጠኑ ሳይለወጥ እንደሚቆይ ስለምናውቅ የቦይል-ማሪዮት እኩልታ በሚከተለው ቅፅ መጠቀም እንችላለን፡
P1V1=P2V 2
ይህ እኩልነት የድምፅ-ግፊት ምርቱ በተወሰነ የሙቀት መጠን ለእያንዳንዱ የጋዝ ሁኔታ ቋሚ ነው ይላል። P2ን ከእኩልነት ስንገልጽ የመጨረሻውን ቀመር እናገኛለን፡
P2=P1V1/V 2
የግፊት ስሌቶችን በሚሰሩበት ጊዜ በዚህ አጋጣሚ ከሲስተም ውጭ የሆኑ ክፍሎችን መጠቀም ይችላሉ፣ ምክንያቱም ሊትሮች ይቀንሳሉ እና ግፊት P2በከባቢ አየር ውስጥ እናገኛለን። ውሂቡን ከሁኔታው በመተካት ለችግሩ ጥያቄ መልስ ላይ ደርሰናል፡ P2=0.8 ከባቢ አየር።






